尽管在1997年3月已成为法律,最终用 户并不急于遵守美国食品和药品管理
局(FDA, Rockville, MD) 21 CFR有关电子记录和电子签名的Part 11 规程。用户常常引用 FDA 的需要为理由,为他们的放慢依从提供了相当充分的解释。
在2002 年4月出版的CONTROL ENGINEERING中发表了一篇题为“我从政府来,我会帮助你”的文章,总括了在电子记录和电子签名方面怎样达到符合 21 CFR 11规程和在实践过程中增进商业利益。
2002年11月,有关咨询更多细节的电话蜂拥而来,FDA发表一个题为“ 21 CFR Part 11,对食品和药品行业的指导:电子记录;电子签名;电子记录的电子拷贝”草案指导文件作为回答。
然后,2003年2月3日,FDA 宣布撤回它的 Pa
存在并很好发挥作用
真实情况是: FDA 并未做任何事去改变或影响 21 CFR Part 11 规程;它只是提出新的创议去增强其现行优良药品制造标准 (cGMP)规划,包括 Part 11。这只是听起来很简单。事实是在过去的25年中,许多 FDA 的优良药品制造标准(GMP)并没有被修改,因而对于希望应用新技术和新发明的用户来讲,FDA经常成了绊脚石。
依照其新的创举,FDA 试图:
◆资源和规程应集中注意力于那些对公众健康造成极大风险的制成品上;
◆ 确保 FDA的工作不会阻碍发明创造;
◆在其各个组成部分,强化 FDA规章方案的一致性。
作为所有改变的一部分CONTROL ENGINEERING China版权所有,监督Part 11 的主要职责被转移到 FDA 的药品评估和研究中心 (CDER),它同样位于Rockville。
2003年2月20日CONTROL ENGINEERING China版权所有,FDA 为21 CFR Part 11发表了一个新的草案指导文件,并提供60天的时间,公众可对此文件进行评论。

新的指导文件表明 FDA 打算重新审查 Part 11,可能对Part 11提出修改,作为它的“21世纪制药工业的 cGMPs的部分:一个基于风险的方案”创议的一部分。在FDA重新审查Part 11的同时,它打算狭义地解释Part 11的范围,并就特定的Part 11条例而言,应谨慎地实行强制性决定。
作为正常操作的部分,这意味着FDA将不采取行政措施来强制依从Part 11的有效性、审计跟踪,记录保存和记录拷贝等要求。FDA还表示对在Part 11的有效日期1997年3月以前运行的某些墨守成规的传统系统实施强制性决定会谨慎。
预测规则
新的指导草案强调预测规则要求的重要性,并需要文件化和说明风险评估的理由。此草案文件包括对软件和计算机系统上现有FDA 指导文件以及对国际药品工程师协会 (ISPE, Tampa, FL)的“对自动化系统有效性的指导”(GAMP)的某些引用。
就其狭义的解释,FDA 对仍然依从Part 11的记录将加强预测规则要求,因此,根据基本的预测规则和为了满足所有其他预测规则要求,被管理的行业应负责保持和提交安全和可靠的记录。
在此同时,FDA发表了它的新的指导文件,ISPE出版了题为“符合21 CFR Part 11的基于风险的方案”的指导文件。
基于风险的评估法则
以 Part 11为出发点控制工程网版权所有,ISPE与 FDA合作,召集一组行业专家www.cechina.cn,采用基于风险的方案对所有的GMP记录调查其依从规程的程度。对该专家组的挑战是探索一种方法来回答 “它是一个GMP 记录吗?”而不是“它是一个电子记录吗?”这样的问题。
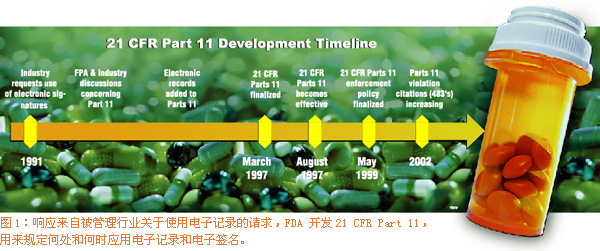
该组提交FDA评议的方法(该方法由FDA批准以便进一步拓展)提供:
◆ 范围— 用户企业应该在预测规则、过程的危险性、产品安全风险、有效性、一致性、纯度和/或质量的基础上,识别和定义有高度影响力的电子记录和电子签名。
◆选择— 用户企业必须实现与电子记录的临界性以及该记录识别的风险相当的控制。这些控制应文件化并有充分理由证明所识别的风险。
在CONTROL ENGINEERING对 Conformity公司 (LianrwstCONTROL ENGINEERING China版权所有, U.K.)董事兼ISPE技术顾问Sion Wyn的一次独家采访中,


 在线会议
在线会议 论坛
论坛 专题
专题 工控直播
工控直播 新闻中心
新闻中心 子站
子站 技术
技术 社区
社区


 2025 (第十四届) 全球自动化和制造主题峰会 ·深圳站
2025 (第十四届) 全球自动化和制造主题峰会 ·深圳站 2025 Raythink燧石红外热像仪有奖试用
2025 Raythink燧石红外热像仪有奖试用.jpg) 立即获取Fluke在线红外热像仪解决方案白皮书
立即获取Fluke在线红外热像仪解决方案白皮书 2025电子及半导体智能制造创新高峰论坛
2025电子及半导体智能制造创新高峰论坛.jpg) 电机与变频驱动故障排除白皮书免费下载
电机与变频驱动故障排除白皮书免费下载

































